Hieff UNICON® Advanced qPCR SYBR Master Mix是2×实时定量PCR扩增的预溶液,具有荧光强度高,灵敏度高和特异性强,扩增产量高等特点,颜色为蓝色,具有加样示踪的作用。核心组分Hieff UNICON® Taq DNA聚合酶采用抗体法热启动,可以有效抑制样品准备过程中引物退火导致的非特异性扩增。同时配方添加了提升PCR反应扩增效率因子和均衡不同GC含量(30~70%)基因扩增的促进因子,使定量PCR可以在宽广的定量区域内获得良好的线性关系。
- 特异性高:抗体法热启动&Buffer优化,最大程度减少二聚体生成
- 灵敏度高:可有效检测低拷贝数模板
- 高荧光值:荧光信号值更高,曲线线型更好,信噪比更高
- 精密度好:可精准区分2倍模板差异,复孔间差距小
- 多平台适用:适用于多种qPCR仪器,无需调整ROX浓度
- 特异性高
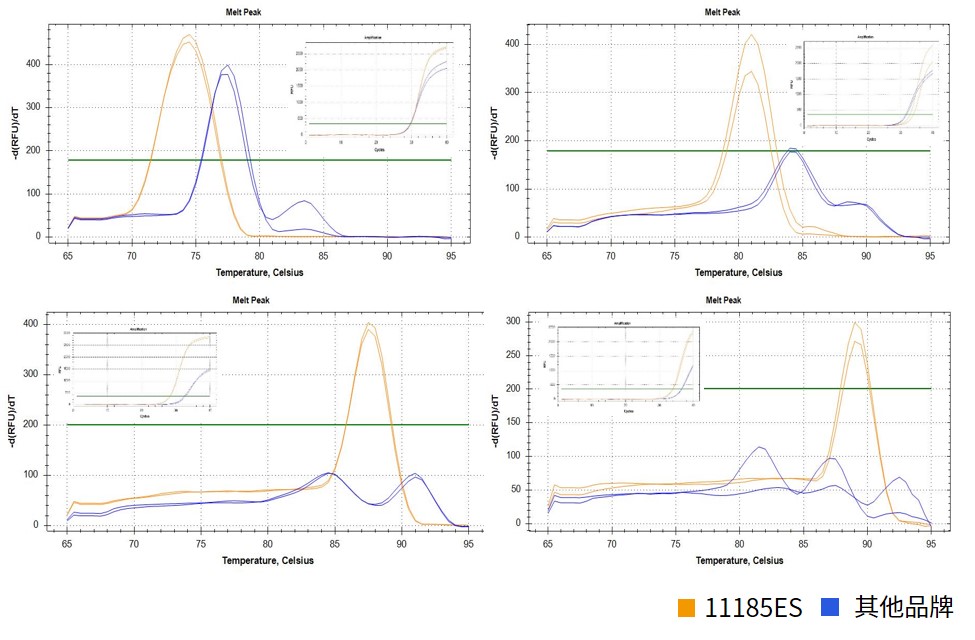
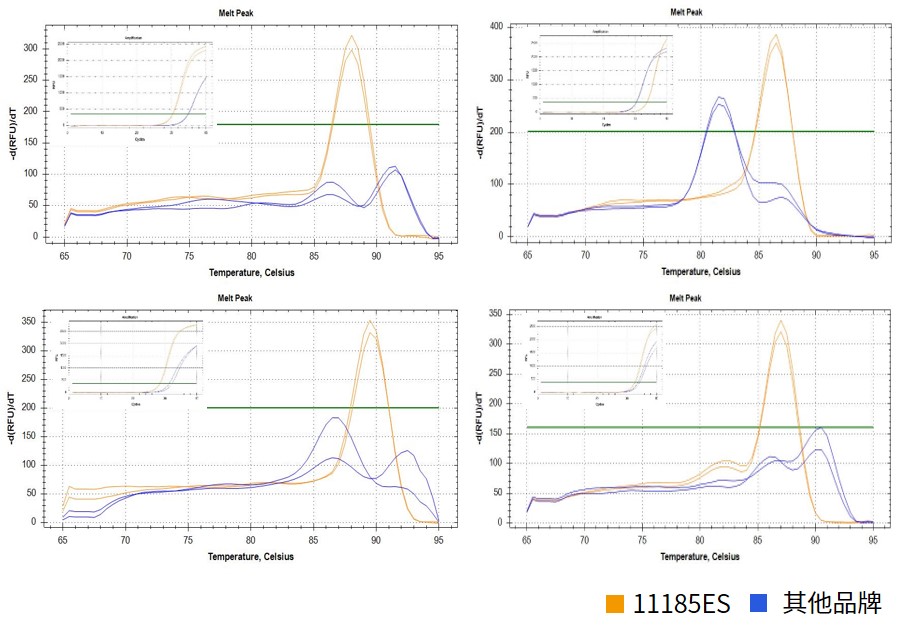
图.以人源cDNA为模板,扩增56组不同GC含量的基因片段(部分曲线如上方展示),结果显示,11185ES的特异性优于其他品牌,数据统计显示11185ES在这些样本中非特异性概率约为5.4%,其他品牌在同种样本中的非特异性概率约为53.6%。

- 灵敏度高
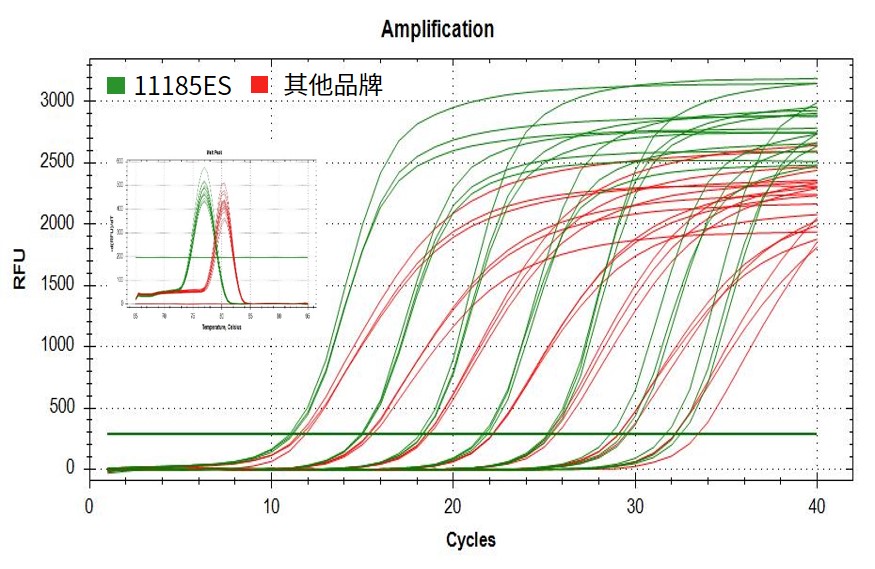
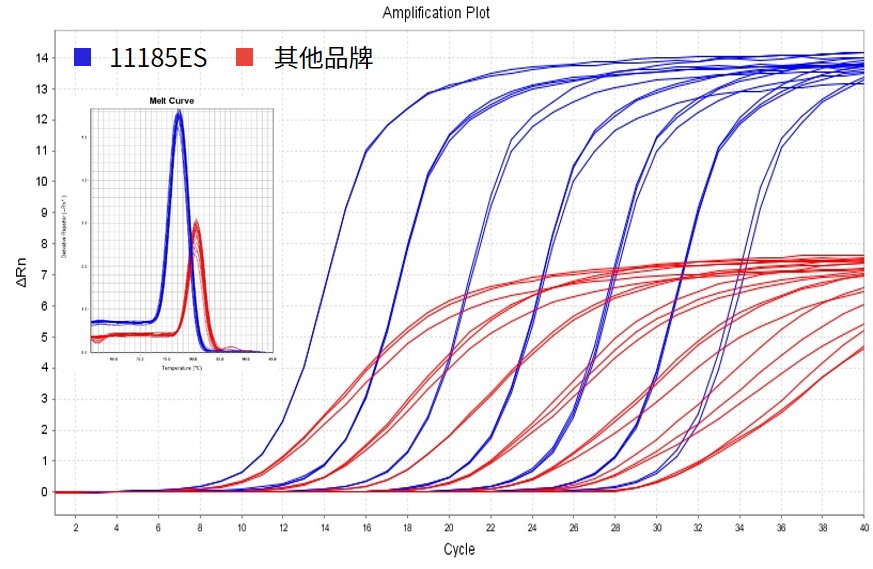
图.分别在不同类型仪器上以101-107拷贝的IL23R质粒为模板,扩增IL23R基因。结果显示在不同浓度模板下,11185ES的灵敏度更加优秀,Ct值更小,同时荧光平台期更高,曲线线型更好,信噪比更高。
- 精准区分2倍模板差异
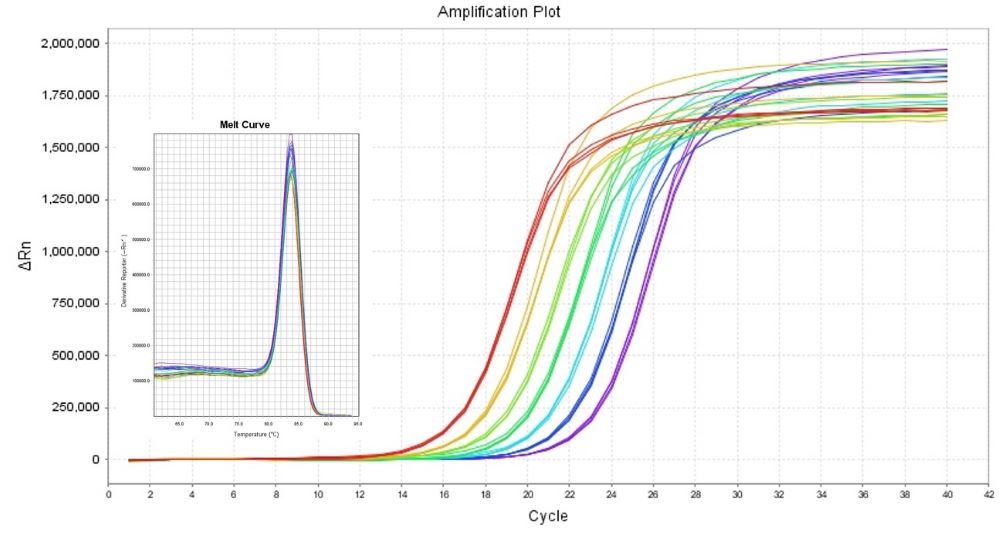
图.分别以稀释10倍、20倍、40倍、80倍、160倍、320倍、640倍的人源cDNA为模板,扩增人GAPDH基因。测试结果显示11185ES能有效区分2倍模板浓度差异。


*备注:模板浓度差5倍,Ct值则相差2.322,22.322=5
图.分别以人源cDNA原液稀释了20倍、100倍和200倍的cDNA为模板,扩增60%GC含量的基因片段。数据显示11185ES针对不同浓度模板的分辨率优于其他品牌,且荧光值更高,曲线线型更好,信噪比更高。
-25~-15℃避光保存,有效期18个月。
Q:建议qPCR 实验用几步法?
A:常用 2 步法。需提高扩增特异性,可选用 2 步法或提高退火温度。在扩增效率低, ct 值过大的时候,可以改用 3 步法或延长延伸时间。
Q:qPCR 实验结果的有效性?为什么建议Ct 值要大于 15?
A:有效性要满足三个条件:(1)标准曲线:扩增效率范围:90-110%,对应斜率为 -3--3.5。 R2>0.98。 (扩增效率=10-1/斜率-1),当斜率=-3.32 时,扩增效率=100%。(2)扩 增曲线:S 型曲线,且 Ct 值在 15-35 之间,阴性对照 Ct>35 或无 Ct 值。(3)熔解曲线:为单一峰。
Ct 值大于 15 个循环是因为 3-15 个循环的荧光值标准差的 10 倍是荧光阈值,Ct 值太小了会影响曲线。
Q:同一基因复孔间熔解曲线 Tm 值有差异?
A:同样的扩增产物也会出现Tm 值有微小差异,一般差异在 1 度以内都可以接受。
Q:为什么稀释了模板CT 值反而变小了?
A:一般 CT 值与模板起始浓度呈负相关,浓度越高,CT 值越小。但也有很多特殊情况, 比如体系中存在抑制物或是模板不纯,这时候稀释模板反而能使 CT 值变低。
Q:为什么扩增曲线杂乱且不连续?
A:可能原因是 ROX 添加不当。确认参比染料ROX 是否添加正确。
Q:模板用量X 是多少?常用的量是多少?
A:(1)X 表示模板 DNA 量需要实验者在首次实验时进行摸索。首先对模板DNA 进行稀释(一般推荐 5-10 倍),然后模板量梯度上样,选择 CT 值落在 20-30 之间的最佳上样量。
(2)常用的量是逆转录 500-1000ng 总RNA,稀释 10 倍取 1μL cDNA 进行qPCR 实验。
Q: 为什么扩增产物跑胶会有拖尾的现象?
A: 试剂中含有稳定性成分,本身不参与任何反应,但在电泳胶上面会表现出弥散状,不建议跑完后再电泳。
Q: 试剂比较粘稠,容易产生气泡,如何避免?
A: 可以先混合大体系,再分别加到离心管里面,最后加模板;
枪头加样不要把空气打进去,二档吸样,一档打样品;缓慢推出液体,不要吹打;沿着壁打入到孔内;
另外配置完后,如果还有气泡,离心PCR管去除。如果是96孔板,移液完后轻轻敲96孔板。