Hieff NGS® In-Situ DNA Binding Profiling Library Prep Kit for Illumina® V2 是针对Illumina®高通量测序平台研发的用于CUT&Tag实验的文库构建试剂盒,适用于100-100,000个细胞起始量的样本建库。CUT&Tag是研究蛋白与DNA互作的技术,相较于传统的ChIP-seq、CUT&RUN,该技术具有文库构建时长更短(仅需7小时)、操作更简单、对起始样本要求更低、抗体投入量更少、文库产量更高等优点。经过细胞捕获、一抗孵育、二抗孵育、转座酶孵育、转座酶激活、掺入DNA标准品、细胞裂解、磁珠回收gDNA、文库扩增和磁珠分选等步骤,靶蛋白结合的DNA片段最终转化为适用于Illumina®平台测序的文库。
本试剂盒包含两个独立模块:BOX-I和BOX-II。BOX-I包含结合细胞的ConA Beads、提取DNA 的DNA Extract Beads以及文库纯化的DNA Selection Beads,BOX-II包含细胞透化剂、抗体结合buffer、转座酶结合buffer、蛋白酶K以及后续文库扩增所需的所有试剂。此外,本试剂盒已在不同种类细胞(如293T、K562、CHO、ESC细胞等)中进行了验证,均具有良好的建库效率和建库产量。本试剂盒提供的所有试剂都经过严格的质量控制和功能验证,最大程度上保证了文库的稳定性和重复性。
- 纯化磁珠升级:表观实验专用磁珠,更多小片段有效富集,结果更可靠。
- pA/G-Tnp升级:精准靶向,切割效率高,背景低。
- 实验流程优化:简化试剂配置,兼容更多样本类型。
- 添加DNA Spike-in:数据标准化,减少实验误差,矫正组间差异。
- 应用方向:蛋白质-DNA互作研究:组蛋白修饰调控、转录因子调控等表观作用机制研究
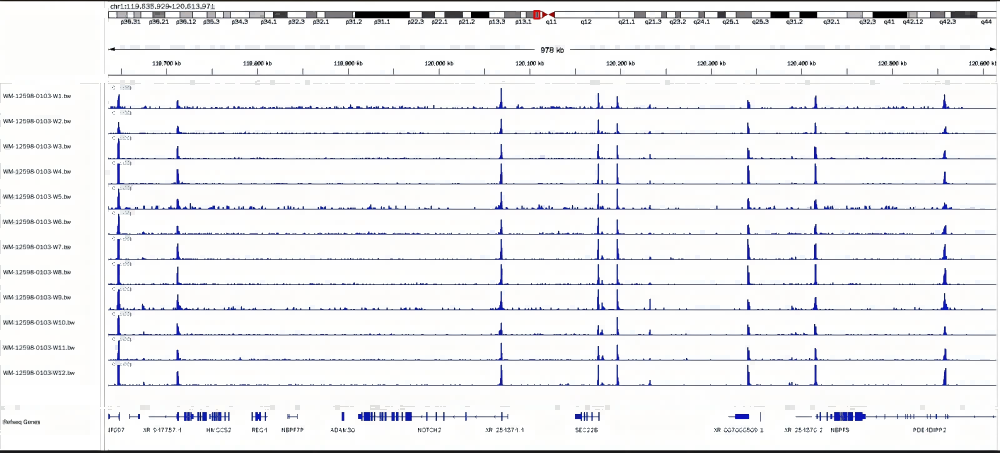
1. 不同投入量细胞实验结果一致性较高
293细胞样本投入细胞100个到10万细胞数,使用H3K4me3抗体,100个到10万个细胞样本结果一致性较高。
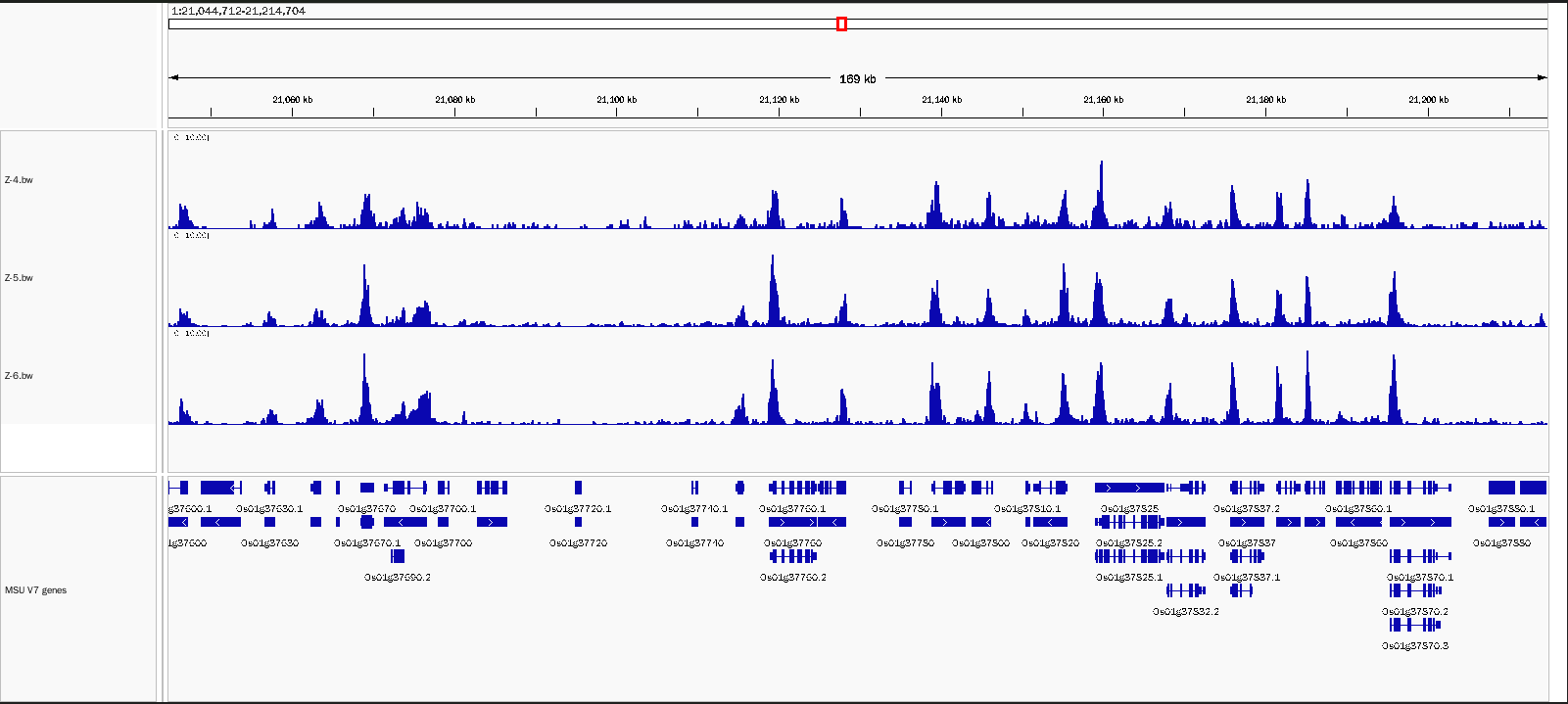
2. 适用植物细胞核样本
选用水稻样本进行细胞核抽提,5万细胞投入量,使用H3K4me3抗体,样本重复性好,背景噪音低。
BOX-I:2-8℃保存,BOX-II:-25~-15℃保存,有效期1年。
PartⅠ:产品定位相关
Q1.本产品是否适用于细菌等原核生物的蛋白核酸互作研究?
A1:原核生物没有组蛋白,且有细胞壁,要做的话建议用 0.3%的甲醛交联后破除细胞壁再去做,理 论上可行。
Q2.请问这个实验能代替 ChIP 实验吗?
A2:对,完美代替 ChIP
Q3.这个可以用来筛选免疫受体所识别的病毒 DNA 区段吗?
A3 :如果定位在细胞核里面应该可以做,在细胞质里面可能会由于 Digitonin 透化细胞膜导致 DNA 片段丢失。建议客户可能先使用甲醛交联,防止 DNA 丢失,再尝试用本试剂盒建库。
Q4.植物转录因子做 cut &tag 有什么限制?我们有个转录因子做ChIP 重复性很差,不知道做 CUT &tag 可不可行
A4 :ChIP 实验不管是组蛋白修饰还是转录因子都存在重复性差、背景信号高的问题,CUT&tag 实验 最大的优势就在于实验重复性好,实验背景信号低。目前已经报道了非常多的样本使用 CUT&Tag 技 术成功的案例,植物样本实验室制备原生质体或者细胞核实验都行。
PartⅡ:产品实验相关
Q5.在植物上融合什么标签比较合适呢?
A5 :这个需要看客户有什么标签抗体,成功率主要取决于抗体是否好用以及蛋白表达丰度。尽量选 择已经测试做 CUT&tag 或者 CUT&RUN 的抗体或者已经有相关文章报道的抗体进行实验
Q6.回收 DNA 的磁珠有单卖的吗
A6:本试剂盒中Box Ⅰ带有 DNA 回收磁珠,客户如需额外购买,本司可以提供(Cat#12601)
Q7.已知的转录因子,做 CUT&tag 实验,是否可以不测序,直接 qPCR 检测目的基因呢?
A7 :可以,但 qPCR 必须在文库扩增之后做,我们的 spike-in 可以作为内参进行相对定量。
Q8.植物中怎么捕获细胞?
A8 :植物细胞在使用本试剂盒建库之前需要破除细胞壁或者直接提取细胞核,植物细胞核提取方法 可咨询翌圣生物,我们有完整的植物细胞核提取方案。
Q9.对抗体的要求如何
A9 :抗体一般按质量标准分为免疫荧光级别、western blot 级别、免疫共沉淀(IP)级别和染色质免 疫共沉淀(ChIP)级别,CUT&tag 或 CUT&RUN 级别,本试剂盒要求的抗体尽量使用更高级别的抗 体。
Q10.回收 DNA 的磁珠可不可以用于做 ChIP 里面的回收 DNA 步骤?
A10 :可用回收,但是 ChIP 实验一般捕获下来的 DNA 太少,而且体积较大,利用磁珠回收可能会有 损失。建议酚氯仿抽提后沉淀,损失会小一些。
Q11.这个实验怎么做重复?平行重复还是独立重复?
A11 :NGS 数据一般是两到三次平行重复。
Q12.想请问一下之前已经甲醛交联过的细胞 还可以做 CUT&tag 吗?
A12 :甲醛交联的细胞可以继续做,但甲醛浓度过高交联时,后续需要增加解交联步骤。
Q13.conA 磁珠用完了,其他组分还有,conA 磁珠有单卖吗?或者有替代品吗?
A13 :19810ES
Q14.spike in mix 具体的作用是怎样的呢 ?
A14 :spike in 主要用于对给实验数据定量提供依据,类似于内参的作用,可以看我们的PPT 上有展 示。对于不知道靶位点的目标蛋白或者处理条件会造成细胞内目标蛋白与 DNA 结合能力大幅度改变 的情况,spike in 能够帮助做出更准确的定量,反映这些情况造成的实验假阴性现象。此外,我们的 spike in 可以用于对目标 DNA 片段进行绝对定量,保证文章数据的准确性。
Q15.是不是需要先构建标签载体,转入原生质体再做后续的?还是用转基因植株做?
A15 :原生质体可以直接用本试剂盒进行实验,植株要先提取细胞核,详情同问题 5 。若有植物靶蛋 白对应的抗体,可直接实验,若无对应抗体,需要构建转基因植株后使用标签抗体实验。
可以。
Q16. 请问有做过杨树的吗?
A16: 目前内部暂未有专门针对杨树物种测试,但理论上是可行的。
Q17.测序数据中的背景噪音,主要指的哪一块,不同的样本有相对的参考么,还是越低越好?
A17 :背景噪音主要来源于抗体的非特异性结合,可以根据文库分布情况以及生信分析的指标判断背 景噪音。
Q18.转基因材料带有 flag 标签就可以直接做吗?
A18 :可用直接做。
Q19.做 cut&tag 总是 duplicate 多该怎么优化呢
A19 :可以适当提高细胞投入量和降低 PCR 循环数
Q20.之前做western flag 标签有非特异条带,这样还能做吗?
A20 :非特异性条带做 CUT&Tag 可能会产生非特异性的结合位点,建议客户更换抗体。如果非特异 性条带不是 DNA 结合蛋白也可以试一下
Q21.IgG 对照也不用做吗?
A21 :建议做的时候带一个 IgG 对照来评判结合特异性。
Q22. 细胞捕获后直接破膜加抗体,后续的孵育切割需要几个小时的时间,这时细胞内的转录因子的 结合会不会产生变化?理论上说,转录因子对外界信号刺激很敏感.
A22:我们使用的缓冲液都是贴近细胞真实状态的缓冲液,影响会比较小。当然,如果担心自己的靶 蛋白和一个结合较弱的转录因子在建库过程中与 DNA 解离了,可以用0.2%的甲醛轻微交联一下。
Q23. IgG 和不加一抗都是背景很高
A23:很有可能是实验过程中,pAG-Tn5 与抗体偶联步骤出现问题,导致 tn5 酶非特异性切割。
Q24.请问打孔之后细胞是否已经失活,与 DNA 结合的蛋白质是否不在脱落?
A24:实验过程中会添加 digitonin 进行细胞打孔,主要作用是为了使抗体以及 pAG-tn5 等大分子进 入细胞核内进行抗体靶向识别及酶切,不会使细胞失活。
Q25. CUT&tag 做组蛋白修饰用的都是通用抗体吗 ?会不会对物种有选择
A25:抗体并非都是通用抗体,同一支抗体并非能识别所有物种,所以实验时,需要根据自己的样本 类型进行测试实验,选取更适合自己样本的抗体。
Q26. 二抗的选择有特殊的要求吗?
A26:首先,二抗需要选择与一抗来源对应,如一抗为兔源抗体,二抗需选择抗兔的二抗,另外,建 议选择含抗体重链和轻链的二抗,并且尽量不要偶联其他标记物如 HRP 、FITC 等。
Q27. 贴壁细胞实验准备时,能使用胰酶消化么?
A27:我们比较建议使用胰酶消化,虽然有地方报道使用胰酶会破坏细胞表明糖蛋白从而破坏细胞与 ConA 的结合,但是使用细胞刮进行刮取时,很容易压迫甚至裂解细胞,造成后续的一些实验背景干 扰。
PartⅢ:产品技术相关
Q28.CUT&Tag 一般适用于哪些类型蛋白质的研究?能否应用于异染色质上的位点?
A28:与 ChIP-seq 相同,CUT&Tag 主要用于分析全基因组范围内的 DNA-蛋白质结合位点分析和组蛋 白修饰研究,包括存在于异染色质区域的蛋白,如存在于染色质压缩缠绕区的 H3K27me3。当用于研 究转录因子时, 转录因子的丰度较低会导致其文库产量也相比组蛋白修饰研究的文库产量低,但同 样可以获得好的测序及数据分析结果。
Q29.CUT&Tag 适用的细胞类型有哪些?
A29:1)常见哺乳动物细胞 CUT&Tag 在常见哺乳动物细胞系上的应用比较成熟,常见的悬浮细胞系 (如 K562)正常离心收集弃去 培养基即可使用。对于大部分贴壁细胞系来说, 可按照常规流程使用 胰蛋白酶消化后得到细胞悬液后可正 常进行 CUT&Tag 实验。需要注意的是,消化后的细胞由于表面 糖蛋白减少,与 ConA 磁珠的结合能力有所 下降,可能会损失 10-20%的细胞。建议可采用刮下的办 法得到悬浮细胞。 另外理论上,CUT&Tag 可以在贴壁细胞中直接使用。ConA 磁珠的主要作用是方 便换液并保持细胞呈分 散状态,鉴于 CUT&Tag 基本逻辑类似于胞内流式或免疫荧光,因此可以参考 免疫荧光的操作路线,用贴壁 较牢固的细胞或适度固定的细胞尝试 CUT&Tag 实验。
2)植物及其他细胞 可采用温和的方式制备原生质体或者提取细胞核进行实验。需要注意的是, 细胞 核与 ConA 磁珠的结合率为~50-80%,完整细胞与 ConA 磁珠的结合率>90% 。 另外理论上,植物细胞 按照免疫荧光进行染色方案可以直接调整到 CUT&Tag 实验,其他物种逻辑上类似。
Q30.在准备实验细胞样品时,对细胞的状态有什么具体要求?
A30:准备实验细胞样品时,对细胞的状态有什么具体要求? 在准备细胞时需要保证细胞处于正常的 生长状态,生长状态不佳的细胞,其胞内的蛋白核酸结合相互 作用状况会发生改变,而死亡细胞的目 的蛋白可能从染色质上的脱离,甚至细胞和染色质的破碎降解,严 重影响实验结果。可以在准备细胞 样品时用台盼蓝染色来鉴定细胞活性,细胞形态正常且样品活细胞占 >90%即可。 对于冻存的样本, 相对于 LN2 快速冻存的样本,更加倾向使用“Mr. Frosty”缓慢冻存的样本。冰冻切片理论上可以直接 在切片上进行 CUT&Tag 实验;事先甲醛固定的石蜡切片也有可能直接进行 CUT&Tag 研究。操作时 按照免疫荧光的操作方式进行。
Q31.如何选择用于 CUT&Tag 的抗体?
A31 :一抗建议使用 ChIP 级别的抗体;对于二抗,则选择与 proteinA/G 亲和力高的抗体(绝大部分物 种都可以)。
Q32.在实验过程中,观测到磁珠有凝聚现象怎么办?
A32:在孵育时间比较长,特别是 4℃过夜的情况下,可能会出现部分磁珠在溶液内凝聚。一般情况下 只要大 部分磁珠仍处于溶液浸润范围内,干结在溶液边缘和液面上方的磁珠比例不大,则仍然能够 得到正常的实验 结果,继续进行后续实验即可。 尽管如此,仍需注意高转速离心或过长时间置于磁 力架,以及磁珠脱离液相时间过长而造成磁珠干结可 能会加剧磁珠的凝聚。在实验过程中应尽量避 免此类操作,以免为实验结果带来不确定的影响。
Q33.对于实验流程中可选的温度条件和时间,如一抗孵育和细胞裂解消化的步骤,该如何进行选择?
A33 :在一抗孵育步骤中,对于组蛋白修饰靶点,或者丰度较大的 DNA 结合蛋白靶点,如 RNA PoI II,在室温下 孵育两小时已经完全足够。而对于丰度较低的转录因子则推荐 4ºC 孵育过夜。 在细胞 裂解后加入 ProteinaseK 消化的步骤中,55℃ 1h 小时和 37℃过夜并无特别大的区别。通常情况下 55℃ 消化 1h 小时即可,较高的反应温度也有利于破坏胞内 DNase 的活性。
Q34.对于 DNA 扩增和建库相关的试剂,如引物和扩增酶,能否使用其他来源的同类试剂?
A34:不建议使用本试剂以外的试剂混搭进行实验。整个说明书的实验流程,包括 PCR 程序都是针对 试剂盒内部所 提供的试剂进行优化的,引入任何非本试剂盒的试剂都可能会造成实验的失败。
Q35.对于 CUT&Tag 的实验样本,二代测序上机应该如何选择?有何特殊的要求?
A35 :推荐常规的双端 150-300bp 测序,如常见 HiSeq 系列。
Q36.对于已经完成的 CUT&Tag 的实验,如何检验实验结果?
A36 :二代测序标准的样检方法:利用 Qubit 荧光计、安捷伦 2100 可以检定文库的产出和片段分布。 合格的文库应该可见类似 ATAC-seq 的典型梯状条带分布,而文库的产量则会因为具体靶蛋白的丰度 不同而不同。若已知靶点结合序列的相关信息,也可设计相应位点的 PCR 引物与 GAPDH 一类的内 参位点对照,通过 qPCR 来确定目的靶点的富集程度。 粗略的实验结果评估可以通过适当增加 PCR 循环数后利用琼脂糖电泳来确定实验是否成功。若同时进行了普通 IgG 替换目的抗体作为一抗的阴 性对照组,则可以在电泳图上看到阳性组和阴性组不同的条带图形。过度的 PCR 会造成大 量的 PCR depulication 而带来大量无效数据,因此也不可以用此类样本进行回收建库上机。 测序数据可以用 deeptools 的 plotHeatmap 或 plotProfile 来判断富集效果。
Q37.CUT&Tag 目标片段富集的不够好是什么原因?如何改进?
A37 参考免疫荧光的经验,CUT&Tag 出现特异性不好的主要原因包括:二抗、转座体(加镁离子之 前)洗涤不够充分;抗体特异性不好、抗体浓度太高等, 建议确定所选抗体是否合适、增加抗体稀释 度、增加洗涤次数来改善。
Q38.阳性对照结果很漂亮,但是目标抗体没有好的富集是为什么?
A38 :1)一般遇到这种情况,首先需要确认抗体质量本身,请选择可靠的 ChIP 抗体,保证您的采购渠 道可信。
2)除非有足够的证据,当使用自己免疫或定制的抗体时,请尽量不要选择多肽免疫的抗体做 CUT&Tag 实验。
3)不同转录因子与 DNA 结合强度不同,或者您的研究对象通过与其他蛋白形成复合物结合在特定的 DNA 片段上,必要时可以使用甲醛交联。弱结合的转录因子容易从目标 DNA 上脱落,不完全是抗体 质量的问题。
4)由于转录因子在可以结合的目标片段往往远少于组蛋白,PolII 等,打断后的 DNA 量较少回收效率 低,建议适当增加细胞量。(由于 CUT&Tag 特异性很好,背景很低,研究转录因子时,电泳看不见 的 DNA 量足够获得很漂亮的结果,由于 DNA 量少,上机时按照传统方法比较难通过测序公司质控, 需要与测序公司特别沟通。
Q39.CUT&Tag 重复性如何?如何评估 CUT&Tag 数据重复性?
A39 :1)基本分析方法参考 ChIP-Seq,同一组样品做三组重复实验,采用 deeptools 做 plotCorrelation 分析。
2)相关分析可以直接使用 BAM 比对文件,或分析 peak 文件,注意两种不同的文件得到的相关性数值 会有较大差异。
3)做相关性分析时,采用泊松分布(pearson)会得到更好的分析灵敏度,注意使用泊松分布时应去除 特别多的 reads( (--removeOutliers )。
4)一般来说,同一次实验相关性在 90%以上,不同条件的两次实验之间应大于 60%(见图) Person 分 布,两次实验细胞数等有差别,BAM 文件组内相关性很好,组间60-70%;峰相关性很好。
Q40.与 ChIP-Seq 不同,由于 CUT&Tag 背景很低,不需要做input,数据分析时应注意哪些问题?
A40:CUT&Tag 贡献信息的主要为单核小体与无核小体片段,因此建议序列比对时尽量选择小片段如 小于 700bp , 在数据量足够时可以只采用<350bp 的片段
[1] Sun S, Jiang Y, Zhang Q, et al. Znhit1 controls meiotic initiation in male germ cells by coordinating with Stra8 to activate meiotic gene expression. Dev Cell. 2022;57(7):901-913.e4. doi:10.1016/j.devcel.2022.03.006(IF:13.417)
[2] Yan QY, Lv JL, Shen XY, et al. Patchouli alcohol as a selective estrogen receptor β agonist ameliorates AD-like pathology of APP/PS1 model mice. Acta Pharmacol Sin. 2022;43(9):2226-2241. doi:10.1038/s41401-021-00857-4(IF:7.169)
[3] Liang T, Bai J, Zhou W, et al. HMCES modulates the transcriptional regulation of nodal/activin and BMP signaling in mESCs. Cell Rep. 2022;40(2):111038. doi:10.1016/j.celrep.2022.111038(IF:9.995)
[4] Jiang H, Bian W, Sui Y, et al. FBXO42 facilitates Notch signaling activation and global chromatin relaxation by promoting K63-linked polyubiquitination of RBPJ. Sci Adv. 2022;8(38):eabq4831. doi:10.1126/sciadv.abq4831(IF:14.957)
[5] Kong X, Yan K, Deng P, et al. LncRNA-Smad7 mediates cross-talk between Nodal/TGF-β and BMP signaling to regulate cell fate determination of pluripotent and multipotent cells. Nucleic Acids Res. 2022;50(18):10526-10543. doi:10.1093/nar/gkac780(IF:19.160)

